化学:2009年命题预测及名师指导(9)
(2)从原子的核外电子排布,理解卤族元素(单质、化合物)的相似性和递变性。
(3)掌握氯气的化学性质,了解几种重要的含卤素化合物的性质和用途。
【导读】应该把卤素放在典型非金属的高度来重点复习。
【试题举例】(2006·上海)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
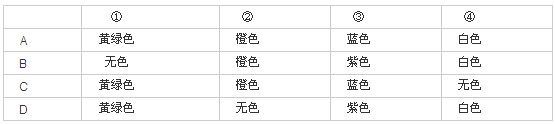
【答案】A
【解析】这是卤素性质的微型实验。①的反应为KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,生成的Cl2为黄绿色的气体;②的反应为2NaBr+Cl2===2NaCl+Br2,Br2溶于水为橙色;③的反应为2KI+Cl2===2KCl+I2,I2与淀粉作用出现蓝色;④的反应为Cl2+2NaOH===NaCl+NaClO+H2O,白色棉球颜色没有变化。
3.其他常见的非金属元素(如:H、O、S、N、P、C、Si)
(1)了解这些元素的单质及某些氧化物、氢化物的性质。
(2)以Na2O2为例,了解过氧化物的性质。
(3)掌握硫酸、硝酸的化学性质。
(4)以硫酸为例,了解化工生产中化学反应原理的确定。初步了解原料与能源的合理利用、“三废处理”与环境保护以及生产过程中的综合经济效益问题。
(5)了解常见盐类的性质和用途。
(6)初步了解常见化肥的基本性质。
(7)了解硫、氮、碳的氧化物对大气的污染及其防治。
(8)初步了解氟氯烃、含磷洗涤剂及粉尘对环境及人类健康的影响。
(9)初步了解生活用水的净化及污水处理的基本原理。
4.其他常见的金属(如:Fe、Al)
(1)了解金属的通性及金属冶炼的一般原理。初步了解金属的回收和资源保护。
(2)掌握Fe和Al的化学性质。
(3)了解常见金属的活动顺序。
(4)以Fe(Ⅱ)、Fe(Ⅲ)的相互转化为例,理解变价金属元素的氧化还原性。
(5)了解铝的重要化合物。
(6)初步了解合金的概念。
5.了解在生活和生产中常见的无机化合物的性质和用途。
6.以上各部分知识的综合应用。
【试题举例】下列有关工业生产的叙述正确的是( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶液铜的质量比阴极析出铜的质量小
【答案】D
【解析】A中分离液氨只能使逆反应速度降低,未影响正反应速度。B中热交换装置利用的是SO2催化氧化放出的热量。C中Cl2在阳极生成。D电解精炼铜时阳极含有杂质,杂质金属如铁能失去电子进入溶液,同时铜离子得到电子在阴极析出,因此D正确。
相关文章
- 高二化学||化学反应速率与化学平衡类试题的解题方法与技巧
- 3大技巧让你高考化学选择题正确率飙升!
- 高考化学必备元素周期表6大知识点及相应29个误区判断
- 高考化学高分必备的二十种物质鉴别方法,收藏!
- 高中化学实验现象80例,学生最好人手一份
- 高中化学有机高考重点知识汇总,考前必须看一遍!
- 高考化学:弱电解质的电离平衡(超实用)
- 化学丨高考化学最容易丢分的30个地方
- 高中化学:化学工艺流程答题规律总结
- 高考化学选择题速度慢,正确率低?这3大技巧让你的正确率飙升!
- 高考化学:化学实验基础知识归纳
- 高中化学:有机化学基础知识点总结
- 【高考化学】化学方程式配平方法大总结!绝招+举例,招招实用!
- 高考化学:失分最严重的实验简答题专项总结!
- 高考化学50条必考基础知识点!要牢记!
- 高考化学:化学常用除杂方法及有机物除杂分析。。。
- 高考化学40个常错知识点,利用碎片时间过一遍
- 送分 | 高考化学常识题常考点,一定要背会喔~
- 解题技巧 | 高考化学元素周期律选择题突破!
- 高中化学实验答题技巧,助你实验题拿满分!
推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,