焓H、功函F、自由能G(2)
dH=dU+pdV+Vdp=δQ+Vdp 因而在等压条件下(dp=0),dH=dQp,表明 H是等压过程中的热量。此时热量dQp只与状态变化有关。同样由第一定律dU=δQ+δW,仅考虑pV功时,dU=δQ-pdV,因而在等容(dV=0)条件下,dU=dQV,表明内能是等容过程中的热量,此时热量 dQV也仅取决于状态变化。经验表明,对一定数量物质的物体加热,结果使物体的温度升高,热量与温






相关文章
教育新鲜事
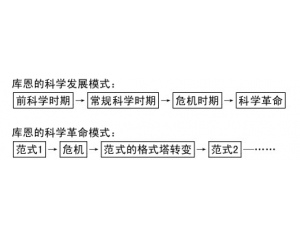 “复式”化学革命模式
“复式”化学革命模式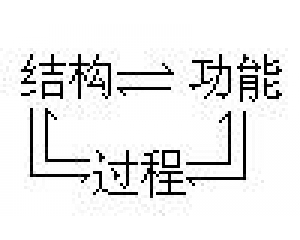 结构、过程与功能的相互
结构、过程与功能的相互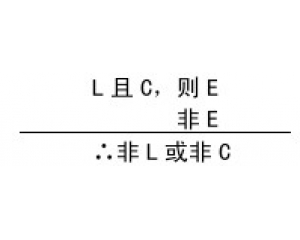 检验的复杂性
检验的复杂性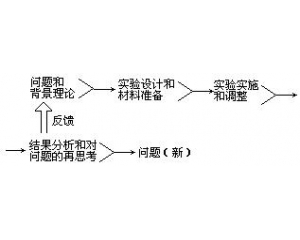 实验操作的程序
实验操作的程序