【涨知识】一遇到陌生的化学方程式就头大,到底怎么写?
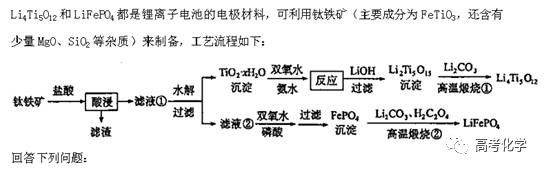
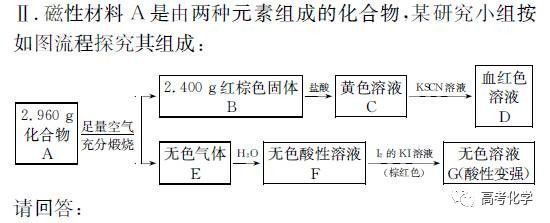
遇到不熟悉的化学反应,要求写化学方程式,找不准反应物和生成物,总是写不对怎么办?今天就给大家分享一下写化学方程式的步骤和注意事项。 常见的要求书写的反应方程式类别主要包括普通型、氧化还原型和电解型,形式分为化学方程式和离子方程式两种,由于化学方程式和离子方程式之间相互转换较为容易,故在此只讨论普通型、氧化还原型和电解型化学方程式的书写。 1 普通型 详解 “酸浸”所用酸为盐酸,由生成物为含Ti物质可知反应物为FeTiO3和HCl,此时发生复分解反应,无元素化合价的变化,因此,反应的离子方程式为 2 氧化还原型 详解 化合物A经过一系列反应后与KSCN溶液反应得到血红色溶液,并且题干中已知A为磁性材料,所以A为Fe3S4,和H2SO4反应生成淡黄色不溶物和气体,由物料守恒可知生成S单质,由标况下气体密度可得气体摩尔质量数值为34,即气体为H2S。可见,S元素化合价升高失电子,则Fe元素化合价应降低得电子,此时发生氧化还原反应,反应物有Fe3S4和H2SO4,生成物有二价铁离子、S单质和硫化氢气体。因此,反应的离子方程式为 【注意】反应物有固体无气体,生成物有气体和固体,气体需标↑符号,固体无须标↓符号。 3 电解型 详解 第一问,反应物为PbO和次氯酸钠,生成物包括PbO2,Pb化合价升高,则次氯酸钠中氯元素化合价应该降低,则生成物应包括氯离子; 第二问,“阴得阳失”,阳极失电子,可知Pb(NO3)2在阳极失电子生成PbO2,PbO2中的氧元素应来源于水,则反应物应包括水,水中含有氢元素,则生成物中应有氢离子,阳极发生的电极反应式为 第三问,阴极得电子,铜离子得电子能力比氢离子强,因此可知铜离子得电子生成铜,则观察到阴极电极石墨上包上铜镀层; 第四问,若不加Cu(NO3)2,则由于铅离子得电子能力比氢离子强,因此铅离子得电子生成铅,电极反应式为 第五问,由于Pb离子在阴极得电子生成单质铅,因此在阳极得电子生成PbO2的质量减少,因此缺点是不能有效利用铅离子。 总结:陌生反应方程式的书写步骤 1、寻找题干中已给的反应物和生成物; 2、判断反应类型(是否为氧化还原反应); 3、根据物料守恒和反应体系的酸碱性判断反应物和生成物中是否应该添加水、氢离子或氢氧根离子; 4、书写完整的化学方程式,配平,注意固体和气体符号; 5、注意题目的要求是写化学方程式还是离子方程式。


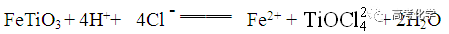

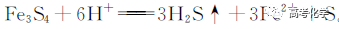

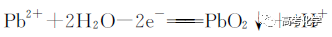
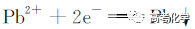
相关文章
- 【高考化学】化学方程式配平方法大总结!绝招+举例,招招实用!
- 干货精选 | 高中化学方程式全汇总,考试时你就知道多有用!
- 一遇到陌生的化学方程式就头大,到底怎么写?
- 难写难背的化学方程式归纳总结,理科生都需要过一遍!
- 高中化学方程式荟萃
- 高中化学:三年“化学方程式”最全总结,错过可惜!
- 干货!五种高中化学方程式的记忆方法。
- 高中化学难写的化学方程式归纳总结,理科生都需要过一遍!
- 高中化学方程式配平经典题目 果断收藏
- 【知识点】高考化学金属部分必须掌握的52个化学方程式!连现象都
- 史上最全:高中三年化学方程式集锦,吐血整理!
- 高中化学方程式九大记忆法宝
- 高中化学|必修一化学方程式大总结,高一预习、高三复习也极好!
- “49人满分,只用1个方法!”高中化学老师“大笑”
- 【收藏】高中化学全部“过量、少量”问题化学方程式总结
- 高中化学难?掌握这130个化学方程式,成绩至少提高30分!
- 高中化学选修五有机化学基础化学方程式整理,非常好非常全面!
- 2017年高考化学:高中化学方程式汇总,觉得有用,直接转走!
- 考试必备!高中化学方程式汇总,快来收藏吧!
- 干货:高中三年化学方程式全在这,请转必有大用!
推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,