相关文章
- 高二化学||化学反应速率与化学平衡类试题的解题方法与技巧
- 高中化学实验现象80例,学生最好人手一份
- 高考化学:化学实验基础知识归纳
- 高考化学:失分最严重的实验简答题专项总结!
- 高中化学实验答题技巧,助你实验题拿满分!
- 高考化学:可逆反应与化学平衡状态(重点)
- 高中化学:失分最严重的实验简答题专项总结
- 高考化学:实验题,不仅要会步骤更要懂原理!
- 【高考化学】化学实验中干燥剂的选用,大题必考!
- 高中化学有机实验的几点注意 | 每日一记
- 高考化学丨“离子浓度”题型考点总结!
- 有关过氧化钠与二氧化碳、水的反应
- 离子反应与离子共存知识点总结
- 高考化学主要实验操作和实验现象的具体实验80例!
- 高中化学实验安全之危险化学品总结
- 高考化学11个常考实验基本操作汇总,不可错过!
- 高考化学 | 化学反应速率知识汇总
- 【知识点】“化学反应速率和化学平衡”知识点归纳
- 【知识点】化学实验超级总结,期中考试就靠它了!
- 高中化学66个离子方程式,全在这儿了
推荐内容
教育新鲜事




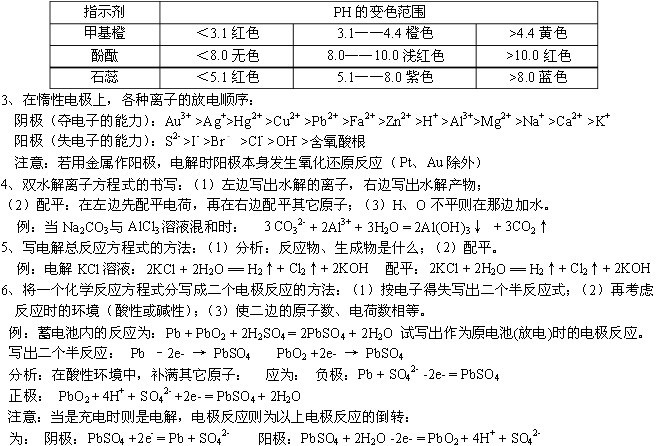






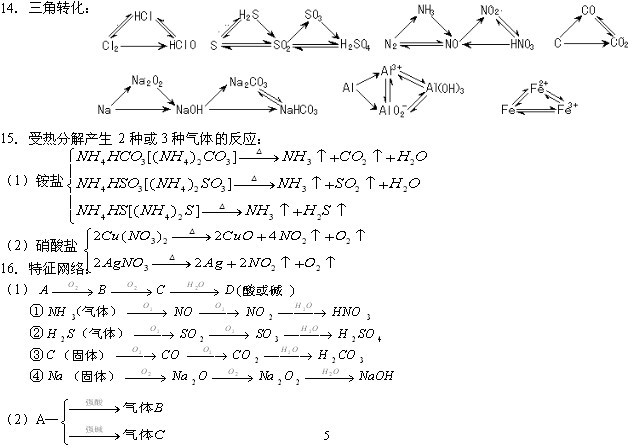
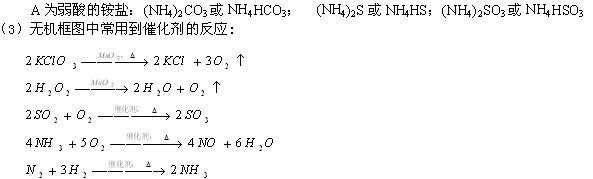

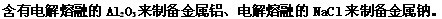

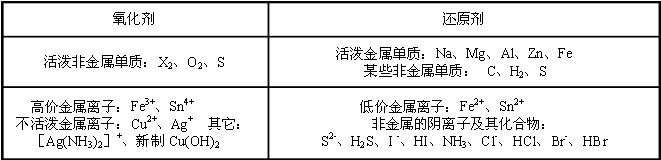
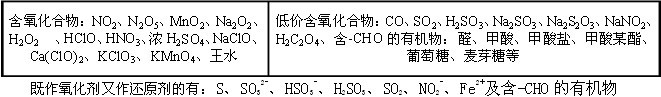
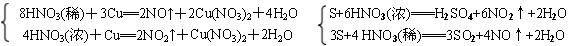
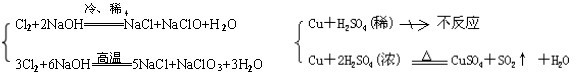


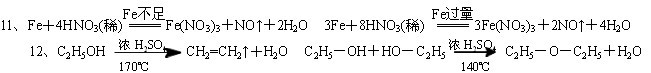
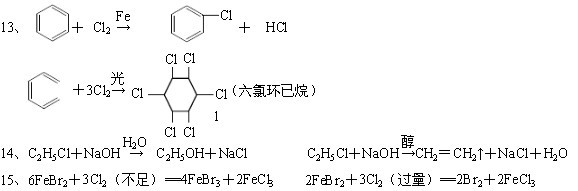





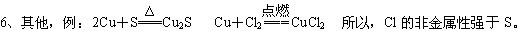
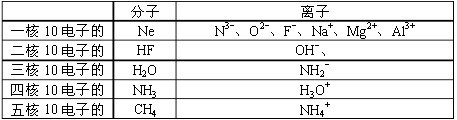
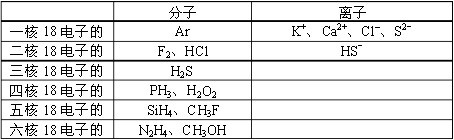




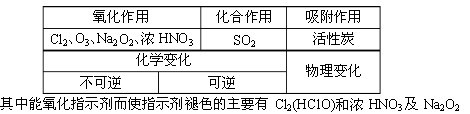


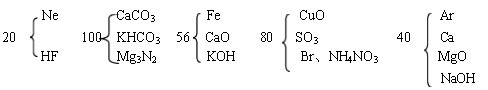
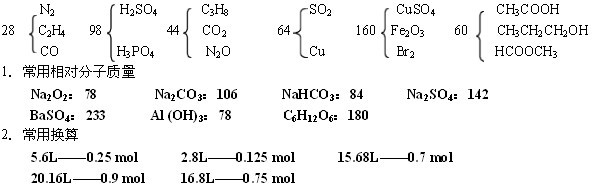







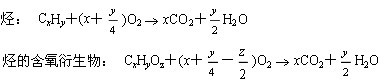
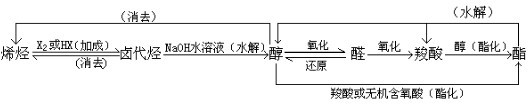
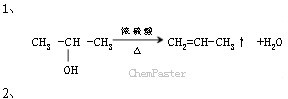
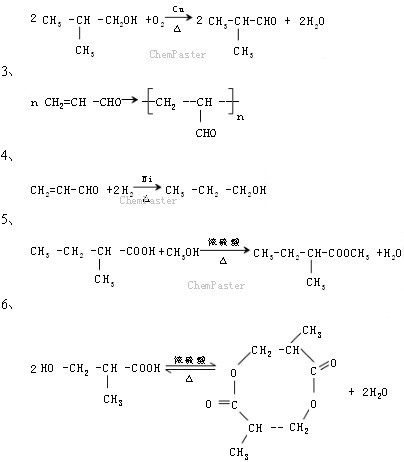
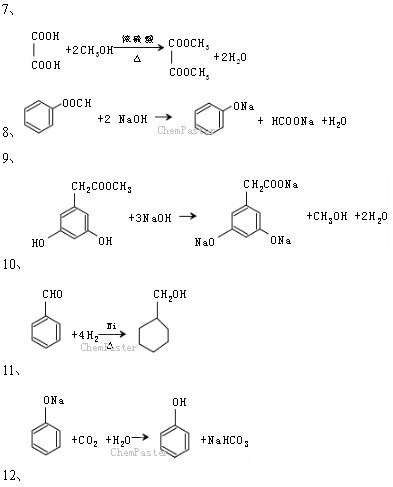
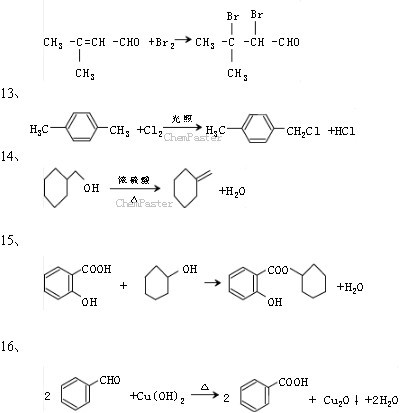





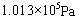 条件下进行,可不予注明;
条件下进行,可不予注明;



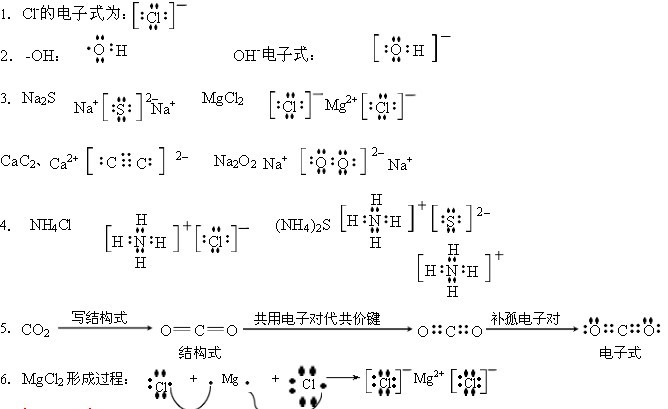



















 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,