甲烷的化学性质
(1)化学性质比较稳定:把制得的甲烷气体通入盛有高锰酸钾溶液(加几滴稀硫酸)的试管里,没有变化。再把甲烷气体通入溴水,溴水不褪色。
(2)取代反应:把一个大试管分成五等分(或用一支有刻度的量气管),用排饱和食盐水法先收集1/5体积的甲烷,再收集4/5体积的氯气,把它固定在铁架台的铁夹上,并让管口浸没的食盐水里。然后让装置受漫射光照射。在阳光好的日子,约半小时后可以看到试管内氯气的黄绿色逐渐变淡,管壁上出现油状物,这是甲烷和氯气反应的所生成的一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和少量的乙烷的混和物。试管中液面上升,这是反应中生成的氯化氢溶于水的缘故。用大姆指按住试管管口,提出液面,管口向上,向试管中滴入紫色石蕊试液或锌粒,可验证它是稀盐酸。如果在阴暗的天气需1~2小时才能观察到反应的结果。
(3)氧化反应:点燃纯净的甲烷,在火焰的上方罩一个干燥的烧杯,很快就可以看到有水蒸气在烧杯壁上凝结。倒转烧杯,加入少量澄清石灰水,振荡,石灰水变浑浊。说明甲烷燃烧生成水和二氧化碳。把甲烷气体收集在高玻璃筒内,直立在桌上,移去玻璃片,迅速把放有燃烧着的蜡烛的燃烧匙伸入筒内,烛火立即熄灭,但瓶口有甲烷在燃烧,发出淡蓝色的火焰。这说明甲烷可以在空气里安静地燃烧,但不助燃。用大试管以排水法先从氧气贮气瓶里输入氧气 2/3 体积,然后再通入1/3 体积的甲烷。用橡皮塞塞好,取出水面。将试管颠倒数次,使气体充分混和。用布把试管外面包好,使试管口稍微下倾,拔去塞子,迅速用燃着的小木条在试管口引火,即有尖锐的爆鸣声发生。这个实验虽然简单,但也容易失败。把玻璃导管口放出的甲烷点燃,把它放入贮满氯气的瓶中,甲烷将继续燃烧,发出红黄色的火焰,同时看到有黑烟和白雾。黑烟是炭黑,白雾是氯化氢气体和水蒸气形成的盐酸雾滴。
(4)加热分解:用125毫升集气瓶,收集一瓶纯净的甲烷。集气瓶口配有穿过两根粗铜电极(在瓶内约为瓶高的二分之一处)和直角玻管的橡皮塞,塞紧(如有孔隙,可涂上一薄层熔化的石蜡),并与盛有溴水的洗气瓶连接(由于反应过程中会有一定量乙炔气体生成)。电极通过感应圈与电源相连。实验时,先放松导管上的夹子,接通6伏电源,铜电极间发生电火花放电,瓶壁上可以看到有炭黑产生,说明甲烷已经分解。稍等片刻,在导管的尖嘴处点火,并用于冷的烧杯罩在火焰上方,可以看到烧杯内壁变得模糊,并有水蒸气凝结,说明有氢气生成。
注意事项:1.此实验成功与否的关键主要取决于药品是否无水。水份的存在会使实验失败。若醋酸钠含有结晶水,加热时晶体会先溶在自己的结晶水里而呈液状,这样就会降低反应温度,延长醋酸钠、碱石灰达到熔化所需时间,甚至达不到失去羧基生成甲烷的温度。因此所用药品须保证无水,即使购回的无水醋酸钠,亦应事先加热干燥后再使用。另外,所用试管也要干燥。
2.在加无水醋酸钠和碱石灰的混和物前,先铺生石灰,其含量多少对反应的成败至关紧要。生石灰用量过少,氢氧化钠固体与试管的接触面大,试管破损率高;生石灰用量过多,妨碍醋酸钠与氢氧化钠接触,使反应速度减慢,产率降低,副产物增多;适量生石灰可防止试管破裂,又因生石灰具有吸湿作用,能除去醋酸钠和氢氧化钠中的少量水分,有利于反应的进行。
3.制取甲烷的反应必须强热才能发生,但过分的强热会产生副反应,所以最好把逸出的气体通过碱溶液和浓硫酸的洗气瓶,或者用排水法把气体收集在细口瓶里,瓶里放一些高锰酸钾酸性溶液,使杂质慢慢被氧化和溶解。
4.在常温下,一氯甲烷为气体,二氯甲烷为液体。在实验室中,只需把反应进行到二氯甲烷的阶段,甲烷和氯气的体积比可采用1∶2.5~3。
5.用口径较小的试管做取代实验时,因为器壁能吸收能量,所以不易爆炸。若用丁烷代替甲烷做实验,不但迅速,现象明显,而且还不会爆炸。
6.在甲烷加热分解的实验里,所有甲烷必须经过检验,以防混有空气,在通电时引起爆炸。
此外,在集气瓶口的橡皮塞必须塞紧,以防通电后气体膨胀把塞子弹开。某它实验方法:甲烷和氯气的反应,不能让阳光直接照射,以免引起爆炸。如果在甲烷和氯气的混和气体中通入少量空气(5%左右),日光照射约20分钟,就可以看到反应结果,若用高压水银灯光照射,5~6分钟就可以看到明显的现象。如果用点燃镁条所产生的强光来照射,立即就能观察到反应现象。
(2)取代反应:把一个大试管分成五等分(或用一支有刻度的量气管),用排饱和食盐水法先收集1/5体积的甲烷,再收集4/5体积的氯气,把它固定在铁架台的铁夹上,并让管口浸没的食盐水里。然后让装置受漫射光照射。在阳光好的日子,约半小时后可以看到试管内氯气的黄绿色逐渐变淡,管壁上出现油状物,这是甲烷和氯气反应的所生成的一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和少量的乙烷的混和物。试管中液面上升,这是反应中生成的氯化氢溶于水的缘故。用大姆指按住试管管口,提出液面,管口向上,向试管中滴入紫色石蕊试液或锌粒,可验证它是稀盐酸。如果在阴暗的天气需1~2小时才能观察到反应的结果。
(3)氧化反应:点燃纯净的甲烷,在火焰的上方罩一个干燥的烧杯,很快就可以看到有水蒸气在烧杯壁上凝结。倒转烧杯,加入少量澄清石灰水,振荡,石灰水变浑浊。说明甲烷燃烧生成水和二氧化碳。把甲烷气体收集在高玻璃筒内,直立在桌上,移去玻璃片,迅速把放有燃烧着的蜡烛的燃烧匙伸入筒内,烛火立即熄灭,但瓶口有甲烷在燃烧,发出淡蓝色的火焰。这说明甲烷可以在空气里安静地燃烧,但不助燃。用大试管以排水法先从氧气贮气瓶里输入氧气 2/3 体积,然后再通入1/3 体积的甲烷。用橡皮塞塞好,取出水面。将试管颠倒数次,使气体充分混和。用布把试管外面包好,使试管口稍微下倾,拔去塞子,迅速用燃着的小木条在试管口引火,即有尖锐的爆鸣声发生。这个实验虽然简单,但也容易失败。把玻璃导管口放出的甲烷点燃,把它放入贮满氯气的瓶中,甲烷将继续燃烧,发出红黄色的火焰,同时看到有黑烟和白雾。黑烟是炭黑,白雾是氯化氢气体和水蒸气形成的盐酸雾滴。
(4)加热分解:用125毫升集气瓶,收集一瓶纯净的甲烷。集气瓶口配有穿过两根粗铜电极(在瓶内约为瓶高的二分之一处)和直角玻管的橡皮塞,塞紧(如有孔隙,可涂上一薄层熔化的石蜡),并与盛有溴水的洗气瓶连接(由于反应过程中会有一定量乙炔气体生成)。电极通过感应圈与电源相连。实验时,先放松导管上的夹子,接通6伏电源,铜电极间发生电火花放电,瓶壁上可以看到有炭黑产生,说明甲烷已经分解。稍等片刻,在导管的尖嘴处点火,并用于冷的烧杯罩在火焰上方,可以看到烧杯内壁变得模糊,并有水蒸气凝结,说明有氢气生成。
注意事项:1.此实验成功与否的关键主要取决于药品是否无水。水份的存在会使实验失败。若醋酸钠含有结晶水,加热时晶体会先溶在自己的结晶水里而呈液状,这样就会降低反应温度,延长醋酸钠、碱石灰达到熔化所需时间,甚至达不到失去羧基生成甲烷的温度。因此所用药品须保证无水,即使购回的无水醋酸钠,亦应事先加热干燥后再使用。另外,所用试管也要干燥。
2.在加无水醋酸钠和碱石灰的混和物前,先铺生石灰,其含量多少对反应的成败至关紧要。生石灰用量过少,氢氧化钠固体与试管的接触面大,试管破损率高;生石灰用量过多,妨碍醋酸钠与氢氧化钠接触,使反应速度减慢,产率降低,副产物增多;适量生石灰可防止试管破裂,又因生石灰具有吸湿作用,能除去醋酸钠和氢氧化钠中的少量水分,有利于反应的进行。
3.制取甲烷的反应必须强热才能发生,但过分的强热会产生副反应,所以最好把逸出的气体通过碱溶液和浓硫酸的洗气瓶,或者用排水法把气体收集在细口瓶里,瓶里放一些高锰酸钾酸性溶液,使杂质慢慢被氧化和溶解。
4.在常温下,一氯甲烷为气体,二氯甲烷为液体。在实验室中,只需把反应进行到二氯甲烷的阶段,甲烷和氯气的体积比可采用1∶2.5~3。
5.用口径较小的试管做取代实验时,因为器壁能吸收能量,所以不易爆炸。若用丁烷代替甲烷做实验,不但迅速,现象明显,而且还不会爆炸。
6.在甲烷加热分解的实验里,所有甲烷必须经过检验,以防混有空气,在通电时引起爆炸。
此外,在集气瓶口的橡皮塞必须塞紧,以防通电后气体膨胀把塞子弹开。某它实验方法:甲烷和氯气的反应,不能让阳光直接照射,以免引起爆炸。如果在甲烷和氯气的混和气体中通入少量空气(5%左右),日光照射约20分钟,就可以看到反应结果,若用高压水银灯光照射,5~6分钟就可以看到明显的现象。如果用点燃镁条所产生的强光来照射,立即就能观察到反应现象。
教育新鲜事
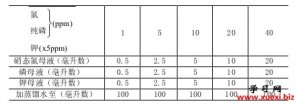 土壤有效养分的化学速测
土壤有效养分的化学速测 利用阿斯匹林进行几种有
利用阿斯匹林进行几种有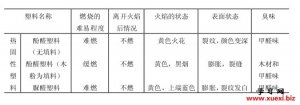 用燃烧法鉴别几种常用的
用燃烧法鉴别几种常用的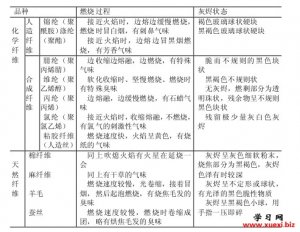 用燃烧法鉴别各种纤维
用燃烧法鉴别各种纤维