速率常数的经验规律
实验和观测结果表明,化学反应的速率不仅取决于速率方程中的各个浓度项,还直接受发生反应的条件—温度的影响,这一影响体现在速率常数中。根据阿累尼乌斯实验定律,化学反应的速率常数可表示为:
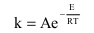


教育新鲜事
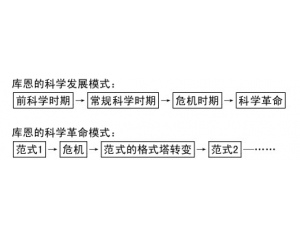 “复式”化学革命模式
“复式”化学革命模式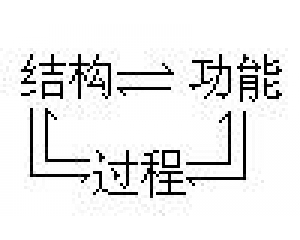 结构、过程与功能的相互
结构、过程与功能的相互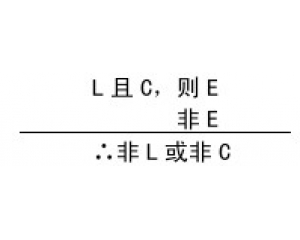 检验的复杂性
检验的复杂性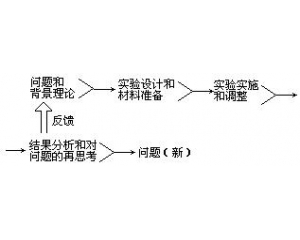 实验操作的程序
实验操作的程序